作成日:
2025/11/19
更新日:
2025/11/26
📝印刷してそのまま使える!Dr.okkeの化学計算問題 厳選5問セットPDF(詳しい解説付き)を無料配布中!ダウンロードはこちら
共通テスト化学は計算問題攻略がカギ
共通テストの化学・化学基礎では、モル計算(mol計算)や化学式・化学反応式を用いた計算問題が毎年必出です。簡単な問題であろうと難しい問題であろうと、化学の計算が絡む問題ではこれらの理解を避けては通れません。
一方で、特に物質量(mol、モル)については、高校化学で新しく出てくる概念であることもあり、つまづいてしまい、苦手なまま進んでしまう人も少なくありません。
これらのテーマについては、まずは「何を表しているか」をイメージして、自在に使いこなせるようになるまで繰り返し基礎問題を解いて、パターン化していくことが重要です。これは、物質量についてのみならず、数学や他の理科科目でも大事な取り組み方になります。
この記事で、化学や化学基礎の基本的な計算問題の考え方をマスターしていきましょう!共通テストを受験する方も必見です。
重要な3分野の考え方のコツを徹底解説!
共通テスト化学・化学基礎に出願される超重要なテーマである「モル(mol)計算」「化学反応式」「濃度計算」について、基本的な考え方から順番に徹底解説していきます。
1. モル(mol)計算:まずは「物質量」を正しく理解しよう
モル計算は化学計算の核となる部分です。ここを理解できると、あらゆる化学反応式の量的関係、溶液の濃度計算などが一気に解きやすくなります。
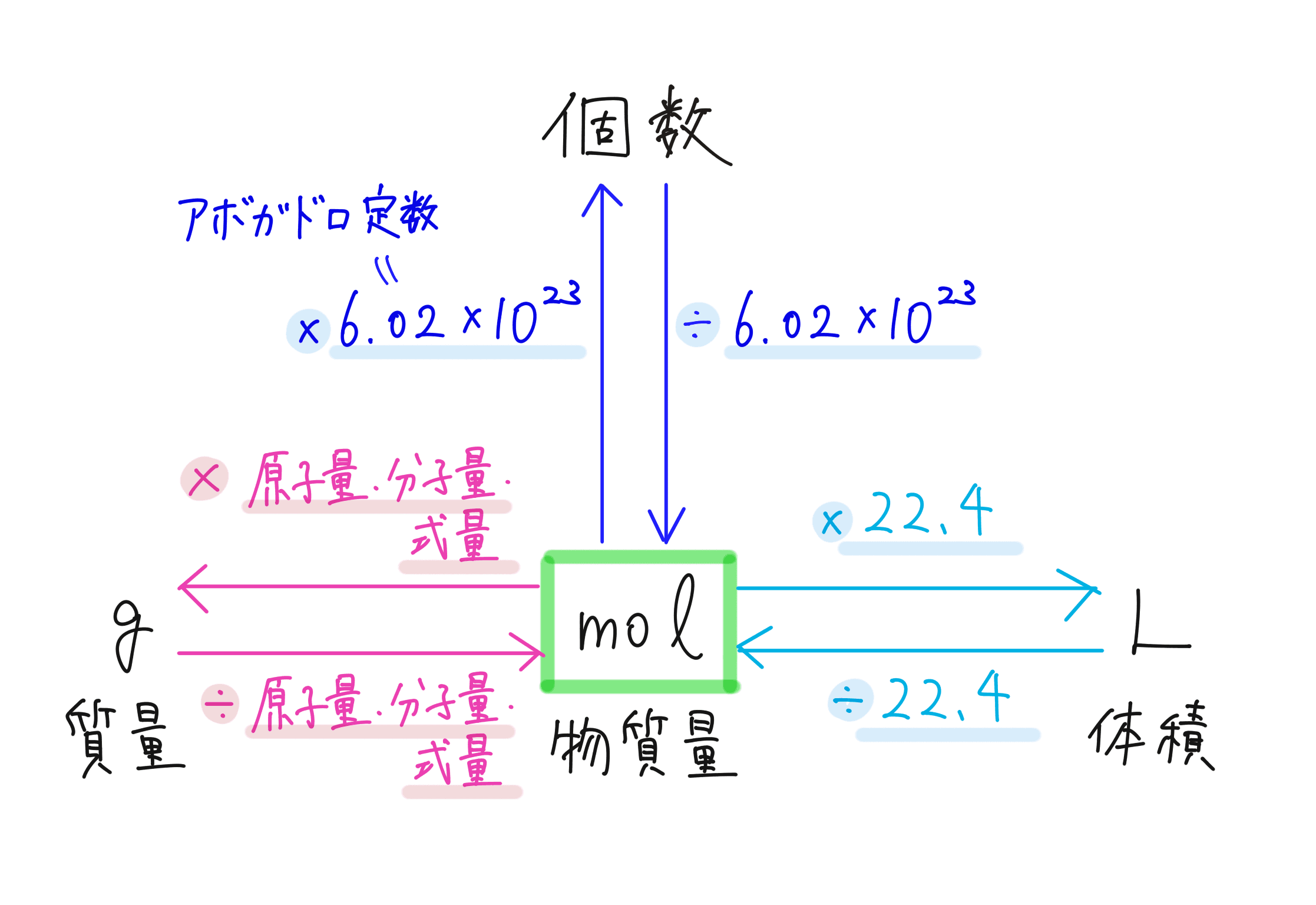
一番最初に理解すべきなのは、「物質量」(mol、モル)とは何を表しているのか?ということです。
まずは、「物質量」 は個数を表す単位で、「1 mol = 6.02 × 10²³ 個」と定義されます(実際には小数点以下にもう少し続きます)。
12個のセットを「1 ダース」と呼びますね。鉛筆なども、12本で1ダースとして売られています。この「ダース」と同じようなイメージです。
物質に含まれる原子などの数はとてつもなく大きいので、本来の個数で表して「1.2 × 10²³ 個の炭素原子が〜」みたいに考えると、数が大きすぎて不便なんですよね。そこで、このような大きな単位を作って、数えやすいようにしたということです。
この 6.02 × 10²³(個/mol)という数のことをアボガドロ定数と呼びます。
これで、「物質量」(mol、モル)と「個数」の概念が結びつきましたね。
あととてもよく出てくるのが、「物質量」(mol、モル)と「質量」「体積」の変換です。これらも必ず押さえておきましょう。
まず、物質量と質量(g)を変換する式はこれです。
原子量/分子量/式量 × 物質量(mol)= 質量(g)
※少し細かいですが、「1 mol」という個数は、この式が成り立つように(原子量/分子量/式量が、1 mol あたりの質量を表すように)定義されているんです。詳しくはこのokke用語の「物質量」のページも参考にしてみてください!
次に、物質量と体積(L)を変換する式はこれです。これは、標準状態の気体について成り立ちます。標準状態とは、気体が0℃、1気圧の条件下のことです。
物質量(mol)× 22.4 = 体積(L)
標準状態の気体については、どんな気体であっても、1 mol 分集めてくると体積が同じ 22.4 L になるということです。結構すごいですよね。
こんな感じで、さまざまな量(個数、質量、体積)と物質量は密接につながっています。物質量を中心にして、いろいろな値を求められるようになりましょう!
2. 化学反応式:「係数の比=物質量の比」が全ての土台に!
化学反応式の係数はただの飾りではなく、どれくらい反応して、どれくらい生成するかを読み取るための最強のツールです。
例えば、この化学反応式を見てみましょう。
2H₂ + O₂ → 2H₂O
水素分子(H₂)が2個と、酸素分子(O₂)が1個反応すると、水分子(H₂O)が2個できる、ということがわかりますね。
上で見たように、物質量は単なる「個数を表すデカい単位」なので、これは、水素分子(H₂)が 2 mol と、酸素分子(O₂)が 1 mol 反応すると、水分子(H₂O)が 2 mol できる、と言い換えることもできます。
つまり、化学反応式の係数の比は、反応/生成する物質量の比を表すのです。
重要なのは、「物質量」の比を表すということです!勝手に、質量の比だと考えたりしないように気をつけましょう。共通テストでは、こういったミスを引き起こすような誤答が作られることも多いです。
ここまでの物質量や化学反応式の読み取りは、共通テストを始めとした、あらゆる化学・化学基礎の計算問題の土台になってきます。
3. 濃度計算(質量パーセント濃度・モル濃度)
モルや反応式を理解できたら、次に、実験問題の設定などでとにかく出てくる「濃度」についても、しっかりと定義をマスターしておきましょう。
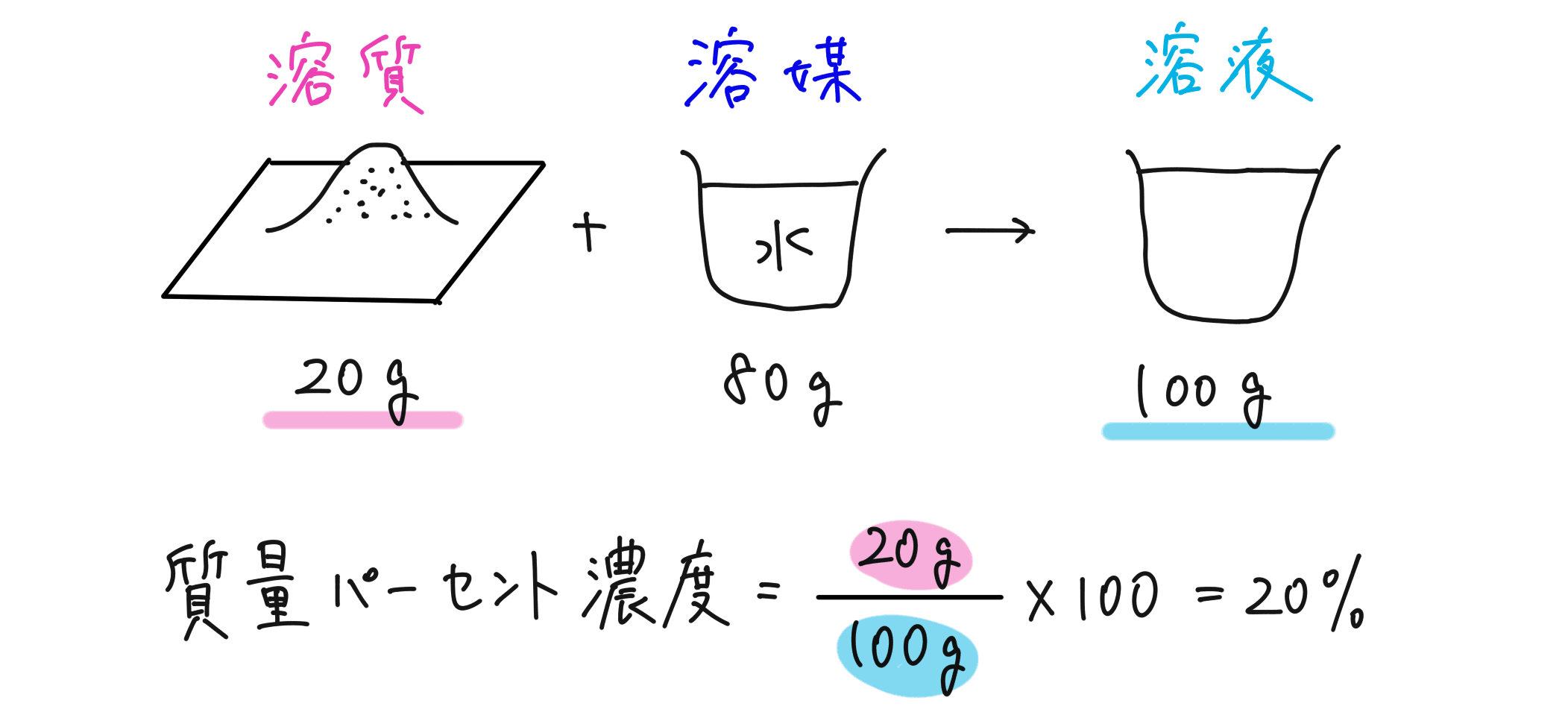
まず、水のように、他の物質を溶かす液体を「溶媒」、溶ける物質を「溶質」、溶けてできあがる液体を「溶液」といいます。
「どれくらい溶けているか」を表す量が「濃度」でしたね。どう測るかによって、濃度にはいくつか種類がありますが、ここでは質量パーセント濃度・モル濃度の2つを押さえておきましょう!(化学を勉強している人は、質量モル濃度も復習しておきましょうね)
まず、溶液の質量に対する溶質の質量の割合をパーセントで表したものを、質量パーセント濃度といいます。
質量パーセント濃度(%)= 溶質の質量(g)/ 溶液の質量(g)× 100
分母は溶媒の質量ではなく、あくまでも全体の溶液の質量であることに注意です!また、パーセントで求めることになるので、 100 を掛けることを忘れないようにしましょう。
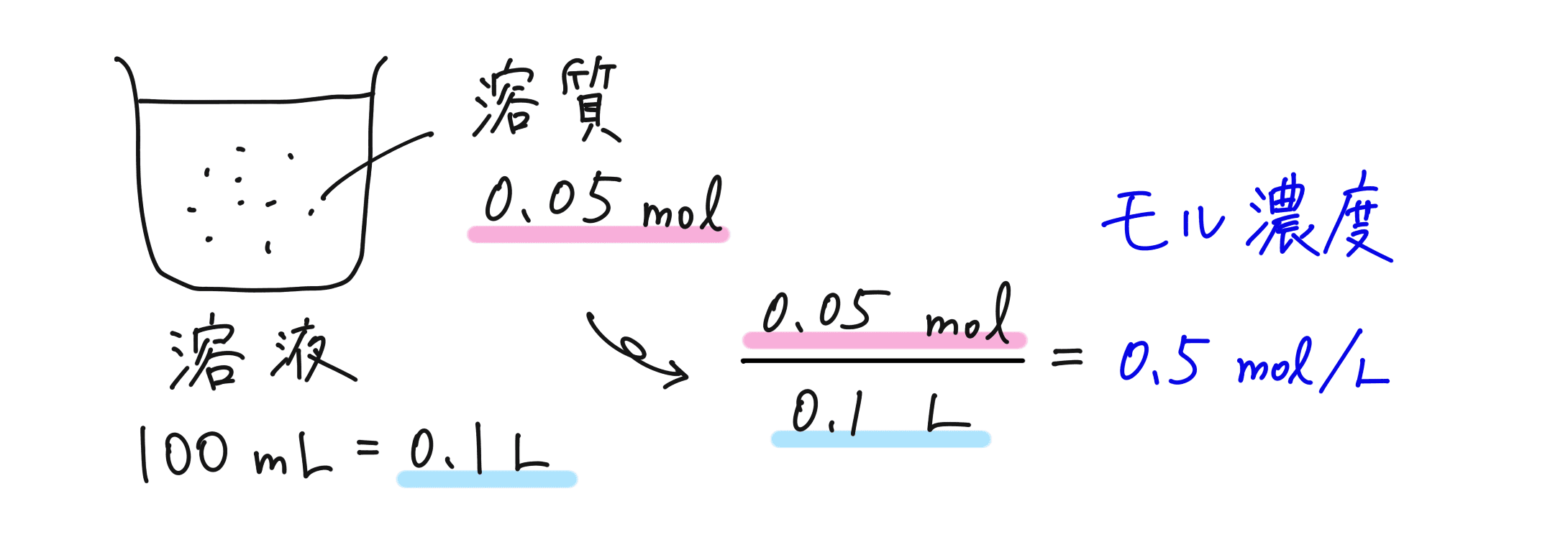
次に、溶液 1 L あたりに溶けている溶質の量を物質量を表したものを、モル濃度といいます。
モル濃度(mol / L)= 溶質の物質量(mol)/ 溶液の体積(L)
モル濃度については、ぜひ単位「mol / L」を覚えておきましょう。この単位から、求め方を思い出せるはずです!また、分母は、mL ではなく L で計算するので注意しておきましょう。
化学の計算演習を積むなら!Dr.okkeの化学計算ドリル
今回説明してきたような、化学・化学基礎の根幹をなす、物質量や反応式、濃度の単元については、使いこなせるようになるまで繰り返し基礎問題を解いて、パターン化していくしかありませんが、実は、基礎問題を計算ドリル形式で特訓できる教材はあまり多くありません。
そこで、テスト演習ツールのDr.okkeでは、これらの特訓ができるように、新たに「化学計算ドリル」という科目をリリースしました。
現在は、化学基礎範囲の前半までの単元の公開を終えており、このように、それぞれのテーマごとに数十問ずつ、さまざまなパターンの計算問題が収録されています。(残りの化学基礎範囲も、2025年内を目処に追加予定)
意外とよくわからないまま使っている人も多い、有効数字についても演習できます。
1問1問について、詳しい解説がつけられているので、「自分がなぜ間違えたのか」も振り返ることができ、確かな実力が身につけられます。
また、紙だけではなく、スマホでも受験ができるので、忙しい受験生でも、移動時間などの隙間時間を活用して取り組むことができます。
さらに、紙ベースでの運用を基本とされている塾様でもご活用いただけるよう、Dr.okkeでは印刷して使える問題出力機能をご用意しています。
今だけ、この機能を使って出力したDr.okkeの化学計算問題 厳選5問セットを無料配布中!
共通テスト対策に、印刷してそのまま使える!
余白が大きいから、直接書き込みながら勉強できる!
導入塾様から好評の、丁寧で詳しい解説つき。
ぜひ共通テスト対策・個別試験対策としてご活用ください!
さいごに
共通テストを含め、化学・化学基礎の計算問題をできるようにするためには、「自分で概念を思い出しながら、自分の手で解く」ことが最も重要です。
また、間違ってしまった場合には、なぜ間違ってしまったのかをなるべく自分で見つけて、やり直すことが重要です。正解を見るだけでは伸びません。「なぜ間違えたか」を理解して、最後まで自力で解き切ることができて初めて、計算力が身につきます。とても地道ですが、ここに近道はありません。
理解と練習を積み重ねることで、計算問題は必ず「解ける分野」へ変わっていきます。
全国の受験生をDr.okkeは応援しています!
執筆者
株式会社okkeマーケティング担当。京都大学総合人間学部/人間・環境学研究科卒。
大手家電メーカーにて新規商材・ECサイト運営を担当後、okkeに入社。
好きな動物は猫とニホンザル。




